一、 新型RNA表观遗传修饰m7G甲基化:神经疾病发病新机制
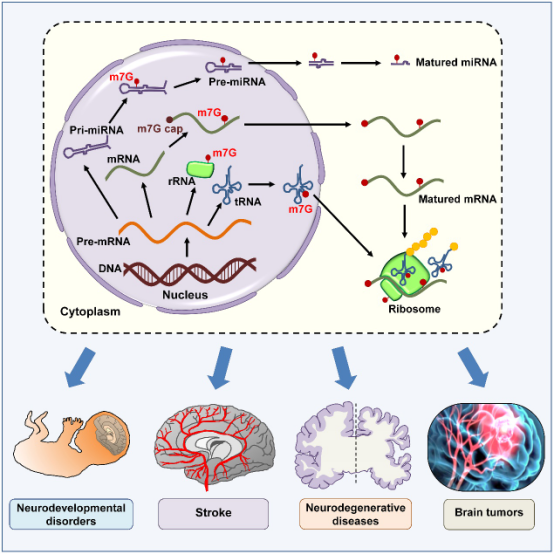
RNA甲基化是目前研究最广泛的RNA表观遗传修饰,目前已有包括N7甲基鸟苷甲基化(m7G)在内的70余种RNA甲基化修饰方式被发现并报道。m7G甲基化作为一种普遍存在且进化保守的RNA修饰,在早前的研究中被认为主要发生在真核细胞mRNA的5′端鸟苷N7位点,介导转录延长、mRNA剪接、出核和翻译等过程。最近的研究表明,包括tRNA、rRNA和mRNA在内的多种RNA的内部位置可发生m7G修饰。m7G甲基转移酶和RNA中m7G修饰位点的发现揭示了m7G修饰在基因表达调控中的重要作用,并提示了m7G失调与包括神经系统疾病在内的各种疾病的关系。
5848vip威尼斯电子游戏郑加麟教授、夏骁寰研究员团队总结了RNA内部m7G修饰研究的最新进展,全面讨论了m7G修饰异常与神经疾病发生发展间的关系,强调了m7G做为神经疾病发病新型机制的重要观点。本综述发表于Molecular Therapy-Nucleic Acids(IF=10.2),5848vip威尼斯电子游戏郑加麟教授、夏骁寰研究员为本文共同通讯作者,夏骁寰研究员和王奕副教授为本文共同第一作者。

本综述首先列举了目前已知的发生m7G修饰的RNA类型,其中tRNA的m7G修饰发生在额外环中的核苷酸46位点,rRNA的m7G修饰发生在人小核糖体亚基18S rRNA 3′主结构域中核苷酸1639位点,以及mRNA的多个核苷酸位点,并进一步介绍了m7G修饰对于各类型RNA的结构和功能的影响。
该综述总结了目前m7G修饰的调控机制,重点介绍了哺乳动物细胞RNA的 m7G修饰由甲基转移酶样1(METTL1)与共因子WD重复结构域4(WDR4)组成的甲基转移酶复合体动态调节,并介绍了METTL1/WDR4复合体在酵母中的同源蛋白、METTL1结合的共性序列以及其他潜在的m7G甲基转移酶和调控分子。
该综述进一步总结了目前已建立的m7G数据库和m7G修饰位点的预测网站,全面列举了目前各类数据库所包括的m7G修饰类型、通量、开发年代、网站地址等信息,为读者更全面了解m7G修饰和未来设计开展m7G研究工作提供了重要信息。
该综述重点总结了m7G修饰与神经系统疾病发病间关系的研究发现,详述了m7G修饰和METTL1/WDR4表达功能异常在原始侏儒症和唐氏综合症等神经发育疾病、脑卒中等急性脑损伤、阿尔茨海默病和多发性硬化等神经退行性疾病、胶质瘤等中枢神经系统肿瘤发生发展中的作用与潜在分子机理。
最后,该综述探讨了未来m7G研究方向:1)新型m7G甲基化writer、reader、eraser的筛选鉴定;2)中枢神经系统中新型m7G修饰方式和位点的发现;3)rRNA和tRNA中m7G修饰在中枢神经系统发育与疾病发病中的作用;4)以m7G为中心的神经系统疾病诊断/预后生物标志物潜在应用价值和治疗策略开发。
原文链接:https://doi.org/10.1016/j.omtn.2023.01.003.
二、 细胞外囊泡:神经疾病致病因子和潜在治疗药物
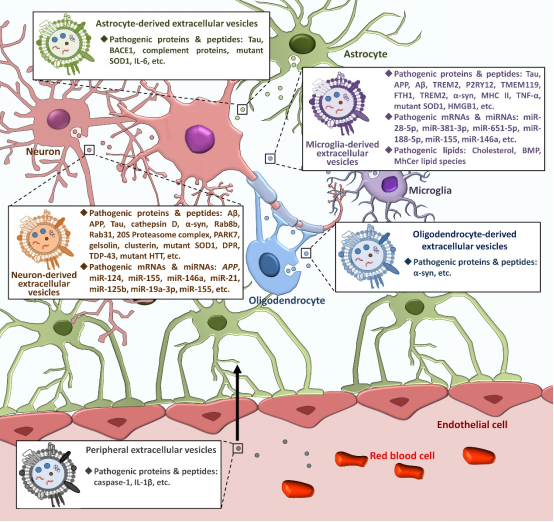
细胞外囊泡(extracellular vesicles,EVs)是一种可由各类脑细胞释放的磷酸双分子层封闭小泡。EV作为一种关键的细胞间通讯介质,通过在中枢神经系统(CNS)内递送生物活性物质成为各种神经退行性疾病发病的重要因素。
5848vip威尼斯电子游戏郑加麟教授、夏骁寰研究员团队总结了中枢神经系统细胞来源EVs在神经退行性疾病发病中病理作用的最新研究进展,讨论了中枢神经系统来源EVs内生物活性分子作为神经退行性疾病生物标志物用于疾病诊断的可行性,并全面讨论EVs作为治疗靶点、药物和药物递送系统在神经退行性疾病治疗中的潜力,以及当前EVs基础研究和临床应用中的关注和挑战。本综述发表于Translational Neurodegeneration(IF=9.9),5848vip威尼斯电子游戏郑加麟教授、夏骁寰研究员为本文共同通讯作者,夏骁寰研究员和王奕副教授为本文共同第一作者。

该综述首先详细介绍了EVs的产生途径及其相关信号通路、EVs内含生物活性分子的类型与特定分子的富集程度、EVs内容物的筛选包装机制、EVs的释放方式和调控信号以及EVs被靶细胞摄取的方式及其介导蛋白。
该综述重点总结了EVs在不同神经退行性疾病发生发展中的作用,详细介绍了来源于神经元、星形胶质细胞、小胶质细胞和少突胶质细胞的EVs对包括阿尔茨海默病、帕金森病、肌萎缩侧索硬化症和亨廷顿舞蹈症在内的各类神经退行性疾病病理进程的影响及其分子机理。
该综述进一步总结了目前将EVs生物活性分子作为神经退行性疾病生物标志物的研究进展,列举了将血液中神经系统来源EVs用于诊断各类神经退行性疾病的有效性、特异性和敏感性,特别强调了EVs作为神经退行性疾病(超)早期诊断的潜在生物标志物的重要价值,同时也提出了目前将血液中神经系统来源EVs作为神经退行性疾病生物标志物的问题和挑战。
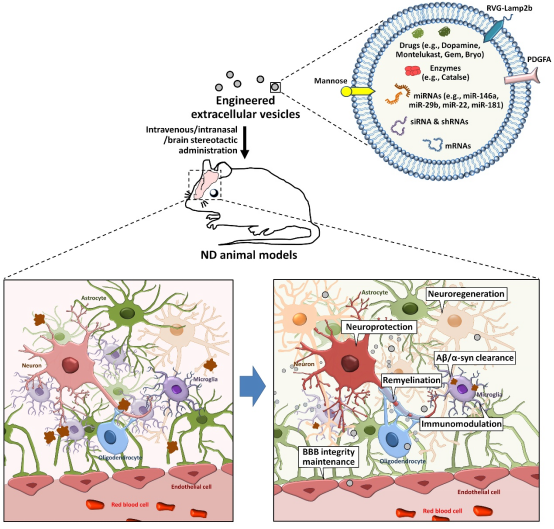
该综述最后还讨论了脑内致病EVs作为神经退行性疾病治疗靶点的可行性、干细胞来源EVs作为神经退行性疾病治疗药物的应用潜力、工程化EVs作为药物递送系统靶向中枢神经系统各类细胞的最新研究进展,强调了目前EVs研究在神经退行性疾病治疗中的巨大转化价值并展望了未来EVs研究方向。
原文链接:https://doi.org/10.1186/s40035-022-00330-0.
三、 神经干细胞来源细胞外囊泡:新型神经疾病治疗方法
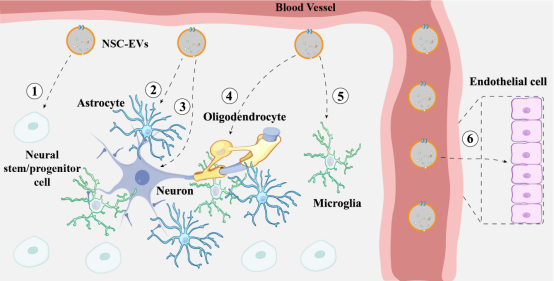
神经干细胞(Neural stem cells, NSCs)凭借其独特的理化性质和生物学功能被证明对神经疾病有着良好的治疗作用。但由于潜在成瘤、免疫风险和伦理等原因,NSC临床应用仍受到很大的限制。NSC来源的细胞外囊泡(NSC-derived extracellular vesicles, NSC-EVs)继承了NSC的神经保护、免疫调控、促神经再生等多种功能,并具有胞内循环释放作用时间长、生物稳定性良好、高穿透力和低免疫原性等特点,有望替代NSC移植成为治疗神经系统疾病的新型药物。
本综述全面总结了NSC-EVs在神经退行性疾病、急性神经系统疾病、痴呆/认知功能障碍疾病等各类神经疾病中的功能研究和应用进展,讨论了NSC-EVs目前存在的研究局限性和未来临床应用中存在的挑战,展望了NSC-EVs进一步的研究方向和在临床/基础研究中的应用前景。本综述发表于Wiley发行的Medcomm,5848vip威尼斯电子游戏郑加麟教授、夏骁寰研究员、王奕副教授为本文共同通讯作者,博士生李乡雨为文章第一作者。

该综述总结了NSC-EVs在不同病理过程中发挥的功能,指出NSC-EVs能够通过调控小胶质细胞功能减轻炎症、激活MEK/ERK通路减轻氧化应激水平、维持血脑屏障通透性、促进神经发生来缓解疾病进程,起到神经保护作用。除了前面提到的神经保护功能外,其他研究还显示NSC-EVs能够调控病毒进入细胞、运输功能性线粒体和改变小胶质细胞的形态。
该综述也总结了不同神经系统疾病中NSC-EVs发挥的作用,包括神经退行性疾病(阿尔兹海默症、帕金森病、多发性硬化、视网膜退行性变等)、急性神经系统疾病(脑卒中、急性脊髓损伤、创伤性脑损伤等)和痴呆/认知功能障碍疾病(高脂饮食脑病、血管性痴呆、辐射性脑损伤、HIV相关脑病等)三个部分,分别阐述了NSC-EVs在不同疾病中的作用模式和功能。
该综述还聚焦NSC-EVs做为潜在药物递送平台的相关研究。通过对NSC-EVs作为药物递送载体在多发性硬化、卒中后缺血缺氧疾病和辐射性脑损伤的应用进行总结,阐述了NSC-EVs作为药物递送载体的良好治疗效果,强调了NSC-EVs可提高神经系统疾病治疗药物的递送效率和安全性。
最后,该综述对NSC-EVs的未来发展方向和目前存在的问题进行了总结:1)需要对NSC-EVs的细胞来源、生成过程和生物组成进行标准化,从而解决NSC-EVs的异质性带来的副作用;2)细胞外囊泡是由外泌体、胞外体和不同类型的小囊泡组成的,区分不同类型囊泡的功能能够增强NSC-EVs的治疗效果;3)目前科学界仍然缺乏对EVs内容物分拣机制的了解,这限制了EVs工程技术的发展;4)仍然需要对EVs表面进行修饰以避免其在循环过程中被免疫细胞吞噬或被其他组织器官摄取;5)需要建立更加安全、有效和高产的NSC-EVs的生产和纯化方式。
原文链接:https://doi.org/10.1002/mco2.214.
四、 小胶质细胞线粒体功能障碍:阿尔茨海默病发病机制研究新视角
阿尔茨海默病(Alzheimer's disease, AD)是世界上最常见的神经退行性疾病之一。越来越多的研究发现,小胶质细胞作为中枢神经系统中主要的免疫细胞,其驱动的神经炎症是AD发生发展的关键因素,但具体机制尚不清楚。
本综述聚焦线粒体功能障碍在小胶质细胞激活及其驱动的神经炎症中的重要作用,在Journal of Neuroinflammation(IF=9.6)发表重要综述,系统性总结了线粒体功能障碍在AD神经炎症中的重要作用。5848vip威尼斯电子游戏郑加麟教授、夏骁寰研究员为本文共同通讯作者,博士生李云为本文第一作者。

线粒体是细胞核外唯一具有遗传效应的细胞器,是一种半自主的细胞器,拥有自己独特的圆形基因组,称为mtDNA。由于缺乏组蛋白的保护,mtDNA极易受到各种损伤,特别是附近产生的活性氧(ROS)。针对人类AD大脑中小胶质细胞mtDNA耗竭的研究发现小胶质细胞mtDNA异常是AD的早期事件。mtDNA通过TLR9、cGAS-STING和NLRP3炎症小体加剧炎症微环境,诱发线粒体功能障碍,引起炎症反应和小胶质细胞活化,最终导致不可逆的神经元死亡和神经胶质功能丧失。
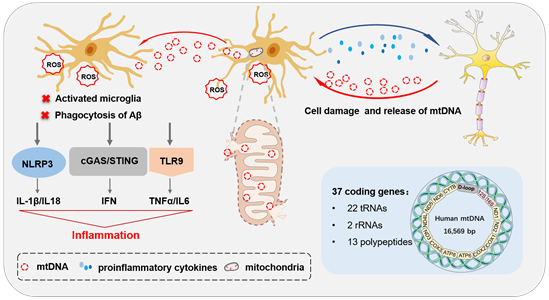
线粒体是细胞的能量工厂,在大脑的能量代谢中起核心作用。线粒体能量代谢是一个复杂的过程,由包括三羧酸(TCA)循环和氧化磷酸化(OXPHOS)/ETC在内的多个部分组成。在AD细胞模型及转基因小鼠脑内均发现了小胶质细胞的代谢重编程。代谢重编程和功能障碍可诱导小胶质细胞活化,导致促炎细胞因子和神经毒性分子的过量产生,从而加剧AD患者的神经炎症和神经毒性。
线粒体质量控制是一个总称,包括线粒体分裂和融合、线粒体运输和线粒体自噬。在AD小鼠模型中,由于线粒体动力学失调,活化的小胶质细胞中线粒体受损。这些受损的线粒体被释放到细胞外,通过靶向附近的星形胶质细胞来诱导先天免疫应答,进而释放出更多功能失调的线粒体,产生正反馈,加速神经炎症。在AD患者脑组织、AD转基因小鼠及细胞模型中,研究人员观察到线粒体功能障碍和线粒体自噬缺陷,并介导Aβ和pTau病理,诱发脑内炎症反应。挽救线粒体过度分裂和线粒体自噬异常可改善相关病理,提示线粒体质量控制异常可能成为AD的治疗靶点。
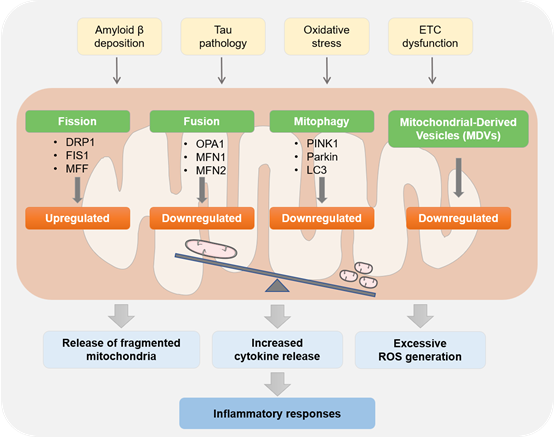
综上,大量证据表明线粒体功能障碍与小胶质细胞介导的神经炎症密切相关。挽救受损的小胶质细胞线粒体,可能是治疗AD的有效靶点。对小胶质细胞线粒体的深入研究将对探究AD发病机制、早期诊断及治疗措施提供新的视角。
原文链接:https://doi.org/10.1186/s12974-022-02613-9.