2月27日,5848vip威尼斯电子游戏袁健教授团队联合美国梅奥医学中心楼振昆团队,在《Molecular Cell》杂志在线发表了题为SLFN5-mediated chromatin dynamics sculpt higher-order DNA repair topology的文章。黄金舟博士和同济的吴晨明博士作为共同第一作者。、

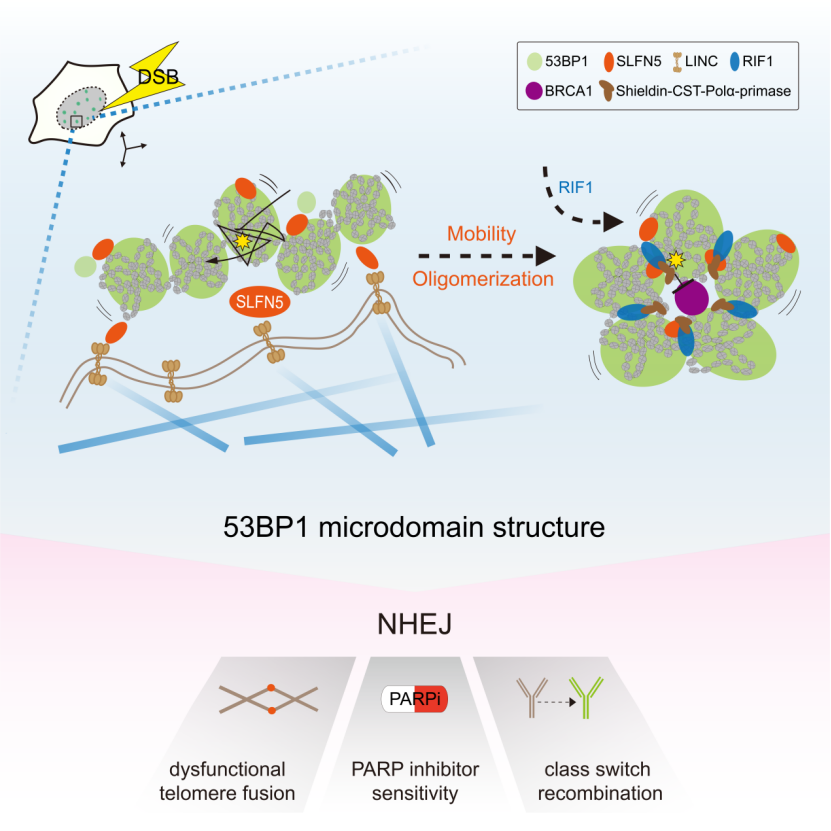
该研究探索了53BP1在DNA断端高阶拓扑排列的关键因素,并提出53BP1-MD高阶结构的塑造需要SLFN5介导的两个过程:(1) 由SLFN5-LINC-微管轴驱动的染色质运动, (2) 由SLFN5调控的53BP1寡聚体的组装。总之,这项研究确立了SLFN5是联系DNA断端染色质动态变化和拓扑重排的关键调节器,并提出染色质动态变化塑造高阶DNA修复拓扑结构的调控模型。
研究首先发现SLFN5在53BP1的邻近标记蛋白质组网络中与SHLD3处于相同的高置信度亚组,提示SLFN5可能是53BP1通路的潜在作用分子。生化实验和邻近连接技术进一步验证了SLFN5与53BP1相互作用,并且SLFN5的相互作用网络扩展到其他NHEJ分子,包括RIF1,PTIP和Shieldin复合体亚基。通过分析乳腺癌病人的基因组WGII (Weighted genome integrity index) 信号,发现SLFN5低表达的病人基因组WGII信号上升,提示SLFN5低表达会对基因组稳定性产生消极影响。
接下来,研究发现SLFN5到DSB损伤位点的招募依赖于53BP1,但不依赖于下游分子RIF1和REV7。另一方面,SLFN5不影响53BP1,RIF1和Shieldin复合体到DSB损伤位点的招募,表明SLFN5可能处于与RIF1-Shieldin不同的功能模块中。值得注意的是,SLFN5缺失导致BRCA1到DSB损伤位点的招募和Foci形成的强度显著增加。作者由此应用超分辨率显微镜对BRCA1和53BP1蛋白进行可视化研究。作者发现在传统显微镜下显示的SLNF5缺失导致BRCA1 foci增强,在超高分辨率显微镜下显示出BRCA1在空间上的扩散分布。有意思的是,与野生型在响应DSB修复形成的环状高阶结构相比较,SLFN5缺失极大扰乱了53BP1-MD的形成,显示为无序的53BP1-NDs排布和拓扑结构的改变。进一步研究显示,当DSB损伤发生时,SLFN5被招募到53BP1-MD高阶结构的界面和边界处。SLFN5的招募动力学与53BP1类似,出现在DNA断裂的早期,并且在随后的1小时内达到峰值。这些数据说明,SLFN5调节了53BP1-MD组装的最初过程。此外,作者在功能障碍的端粒中也观察到53BP1-MD高阶结构,且SLFN5缺失导致此端粒上的拓扑结构被破坏。这些数据表明,SLFN5是53BP1-MD高阶结构的关键调控分子。
研究进一步探索SLFN5与53BP1相关功能之间的联系。他们发现,Slfn5 基因敲除(Knockout,KO)可以极大抑制由NHEJ介导的功能障碍端粒 (端粒保护蛋白Trf2-KO)的融合。来自Slfn5-KO小鼠胚胎的MEFs显示比野生型更多的染色体异常断裂。通过对Slfn5-KO小鼠的脾脏进行分析发现γH2AX信号的显著积累,同时血液中红细胞的微核数目也出现显著增加。这些数据进一步表明SLFN5与基因组稳定性的维持密切相关。接下来,作者发现Slfn5-KO小鼠中B细胞的抗体类型转换重组(Class switch recombination, CSR)的过程被抑制。同时,在BRCA1-KO的细胞中,SLFN5的缺失可以恢复HR及DNA断端的切除效率,并使细胞对PARP (poly (ADP-ribose) polymerase) 抑制剂重新耐受。此外,作者发现SLFN5缺失导致HR的增加并抑制NHEJ的修复,提示SLFN5参与DSB修复途径的选择。这些结果表明,SLFN5是NHEJ途径的关键分子,并且SLFN5与53BP1在功能上具有遗传上位性 (Genetic epistasis)。
SLFN5 的N端推测具有核酸酶活性,C端具备Walker A和Walker B结构域,提示具有解旋酶活性和ATP酶活性。作者通过构建不同的酶活突变体发现,SLFN5的ATP酶活性对于53BP1-MD的组装和SLFN5在NHEJ的功能是不可或缺的。53BP1通过招募SLFN5到DNA断端来促进其高阶结构形成,那么53BP1是否存在一个具体的区域负责SLFN5的招募?作者通过引入不同的53BP1截断体,将参与SLFN5招募的区域范围缩小到了Mob (影响53BP1介导的染色质运动) 和Core (影响53BP1寡聚化的形成) 的区域。这些数据提示SLFN5可能参与的是53BP1依赖的染色质运动和寡聚化。接下来,通过对受损伤染色质移动性的分析,作者发现,DNA断端染色质的运动受到SLFN5的严格调控,这一过程需要53BP1 Mob区域的相互作用和SLFN5 的ATP酶活。与此同时,SLFN5的缺失也会极大影响53BP1寡聚化的形成。有意思的是,将53BP1的Mob或Core区域进行突变都可以破坏53BP1-MD高阶结构。同时,作者发现,Mob和Core区域的双突变可以破坏53BP1对DNA断端的保护作用。这些数据说明,53BP1介导的染色质动态变化是其形成高阶拓扑结构的必要条件。
先前研究发现微管-LINC复合体促进53BP1调节的染色质运动,尽管LINC如何与53BP1进行连接并不清楚,可能中间存在一个X因子。基于上述实验结果,作者探索SLFN5作为连接的X因子的可能性。通过对微管的化学扰动,可以发现53BP1-MD高阶结构的紊乱。此外,LINC复合体亚基SUN1和SUN2与SLFN5强烈相互作用,并且SUN1和SUN2的缺失扰乱53BP1-MD高阶结构,这与SLNF5缺失导致的表型类似。这些结果表明,微管-LINC复合物促进DNA断端的移动性,并驱动了53BP-MD的拓扑排列,而这一过程由SLFN5介导。
总的来说,该研究发现SLFN5是调节53BP1在DNA断端形成高阶拓扑结构的关键分子。当DSBs触发53BP1围绕染色质形成纳米域 (ND) 时,SLFN5促进受损染色质运动和53BP1的寡聚化,促使形成更高阶的53BP1微米域 (MD)。RIF1随后稳定了这一拓扑结构。SLFN5的缺失会导致53BP1-MD的拓扑结构被破坏,引起BRCA1在染色质的过度弥散,导致DNA断端的过度切除和影响基因组的稳定性。该研究表明SLFN5和RIF1在53BP1这一空间事件上存在时间差异性。与RIF1的晚期招募行为相比较,SLFN5的招募与53BP1几乎同时发生,并主要定位在53BP1-MD的界面和边界处,因此认为SLFN5的招募主要调节53BP1-MD拓扑重排的最初步骤,而53BP1-MD一旦形成,RIF1有助于维持该结构的稳定。
原文链接:https://doi.org/10.1016/j.molcel.2023.02.004